Selamat
pagi kawan, pada kesempatan yang baik kali ini mimin akan membagikan sekilas
informasi tentang pengertian termodinamika, sistem termodinamika, proses termodinamika dan keempat hukum termodinamika. Tanpa
perlu berlama-lama, mari kita lihat penjelasannya di bawah ini
C. PROSES TERMODINAMIKA
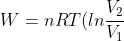)

2. Proses Isokhorik
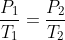
- Usaha bernilai nol; W=0
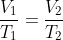
- Usaha; W=P(V2 - V1)

D. HUKUM TERMODINAMIKA
Pada umumnya, Hukum Termodinamika terdapat 4 Hukum, yaitu Hukum 0 Termodinamika, Hukum I Termodinamika, Hukum II Termodinamika, dan Hukum III Termodinamika. Adapun penjelasan dari masing-masing adalah sebagai berikut:
A. PENGERTIAN TERMODINAMIKA
Termodinamika
berasal dari bahasaYinani yaitu thermos yang
berati panas dan dynamic yang berarti
perubahan. Termodinamika merupakan suatu ilmu yang menggambarkan usaha untuk
mengubah kalor menjadi energi serta sifat-sifat pendukungnya.
Termodinamika
mempelajari sifat-sifat panas dan cara-cara panas atau kalor ditransfer.
Sekilas, termodinamika adalah bidang ilmu khusus yang rumit dengan
aplikasi-aplikasi penting. Ternyata termodinamika memiliki aplikasi-aplikasi
penting dihanmpir setiap cabang fisika.
Termodinamika
berkembang di abad ke-18 dan 19 dari studi mesin uap. Walau mesin semacam
inibtelah mendorong munculnya revolusi industri, prinsip-prinsip fisika dibalik
cara kerja mesin uap ini tidak begitu menjadi perhatian hingga ilmuwan Prancis
Nicolas Sadi Carnot mengembangkan model mesin kalor yang lebih umum di tahun
1820-an.
Termodinamika klasik membatasi pertimbangan-pertimbangannya terhadap
sifat-sifat materi makroskopik atau skala besar daripada sifat-sifat atom
individual materi. Namun demikian, sama halnya dengan teori kinetik gas,
hukum-hukum dasar termodinamika bisa diperoleh secara statis dengan membuat
model sifat rata-rata sejumlah besar partikel.
Konsep
temperatur dan panas terletak di jantung termodinamika. Panas adalah sebuah
bentuk energi yang bisa ditransfer di antara materi-materi, sementara suhu
adalah sifat materi bawaan akan tetapi bisa diubah. Dalam mekanika statistika,
temperatur diinterpretasikan sebagai pantulan energi kinetik atau ketika
temperatur suatu zat meningkat, maka energi kinetik rata-rata atom atau molekul
juga meningkat.
Bergantung
pada struktur internal, materi-materi yang berbeda merespon panas dengan cara
berbeda, seperti yang ditunjukkan oleh fakta bahwa jumlah panas yang sama yang
diberikan pada jumlah dua zat yang serupa akan meningkatkan temperatur mereka.
Respon materi terhadap aplikasi-aplikasi panas dijelaskan oleh sebuah kuantitas
yang dikenal sebagai kapasitas panas, sementara transisi antara fase-fase
materi memerlukan pengurangan atau penambahan energi tambahan yang dikenal
sebagai panas atau kalor laten.
B. SISTEM DALAM
TERMODINAMIKA
Sistem
dalam termodinamika dibagi menjadi tiga sistem yaitu, Sisitem Terbuka, Sistem
Tertutup dan Sistem Terisolasi. Adapun penjelasan ketiga sistem tersebut adalah
sebagai berikut.
1.Sistem Terbuka: ada pertukaran massa dan energi sistem
dengan lingkungannya. Contoh: lautan, tumbuh-tumbuhan
2. Sistem Tertutup: ada pertukaran energi tetapi tidak
terjadi pertukaran massa sistem dengan lingkungannya. Contoh: Green House ada pertukaran kalor tetapi
tidak terjadi pertukran kerja dengan lingkungannya.
3. Sistem Terisolasi: tidak ada pertukaran
massa dan energi sistem dengan lingkungan. Contoh: tabung gas yang terisolasi.C. PROSES TERMODINAMIKA
Dalam
Termodinamika dikenal dengan lima proses, yaitu Proses Isotermis (Isotermal),
Proses Isokhorik, Proses Isobarik, Proses Adiabatik. Adapun penjelasan dari
kelima proses tersebut adalah sebagai berikut:
1. Proses Isotermal
-
Berlangsung pada suhu tetap (∆T = 0)
-
Sesuai dengan hukum Boyle; (P1V1=P2V2)
- Rumus Usaha;
-
Usaha= luas daerah di bawah kurva.
2. Proses Isokhorik
-
Berlangsung pada volume tetap (∆V = 0)
-
Sesuai dengan hukum Charles:
- Usaha bernilai nol; W=0
-
Usaha = luas daerah di bawah kurva
3. Proses Isobarik
-
Berlangsung pada tekanan tetap (∆P = 0)
-
Sesuai dengan hukum Charles-Gay Lussac
- Usaha; W=P(V2 - V1)
-
Usaha = luas daerah di bawah kurva
4. Proses Adiabatik
-
Merupakan proses perubahan keadaan gas tanpa ada aliran kalor masuk maupun
kalor dari sistemn(Q=0)
-
Berlaku rumus Poison, yaitu:
atau

-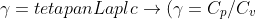)
- Usaha pada proses adiabatik adalah negatif dari perubahan energi internalnya:
-
- Usaha pada proses adiabatik adalah negatif dari perubahan energi internalnya:
W=
- ∆U
D. HUKUM TERMODINAMIKA
Pada umumnya, Hukum Termodinamika terdapat 4 Hukum, yaitu Hukum 0 Termodinamika, Hukum I Termodinamika, Hukum II Termodinamika, dan Hukum III Termodinamika. Adapun penjelasan dari masing-masing adalah sebagai berikut:
Hukum 0 Termodinamika
Hukum
0 Termodinamika mengatakan bahawa kesetimbangan termal berlaku universal,
dengan kata lain apapun zat dan materi benda akan memiliki kesetimbangan termal
yang sama apabila zat atau materi benda itu disatukan. Hukum 0 Termodinamika
menyatakan bahwa:
“Jika dua sistem berada dalam kesetimbangan
termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu
sama lain”.
Hukum I Termodinamika
Hukum
I Termodinamika mengatakan bahwa energi (kalor)
yang diberikan ke dalam sebuah sistem yang sama dengan jumlah perubahan energi
dalam sistem ditambah kerja yang dilakukan sistem. Hukum I Termodinamika ini
merupakan hukum kekekalan energi yang
menyatakan bahwa:
“Energi tidak dapat diciptakan dan
dimusnahkan, tetapi hanya bisa dirubah dalam bentuk satu ke bentuk yang
lainnya.”
Secara
umum, Hukum I Termodinaka ini menyatakan bahwa kita hanya dapat mengubah bentuk
suatu materi (ingat materi mempunyai massa dan massa memiliki kesetaraan dengan
energi) ke bentuk yang lain tanpa dapat membentuk suatu materi (energi). Jadi
manusia hanya berperan, termasuk alat-alat buatan manusia, hanya sebatas
mengubah sesuatu ke bentuk sesuatu yang lain tanpa ada yang ditambahkan ke
dalamnya. Dengan melakukan pengubahan bentuk sesuatu materi ke bentuk yang lain
manusia dapat menggunakan alam dan alat-alat buatannyauntuk tujuan pemenuhan
kebutuhannya.
Hukum II Termodinamika
Hukum
II Termodinamika ini membatasi perubahan energi mana yang bisa terjadi dan
tidak. Hukum II Termodinamika ini mengatakan bahwa:
“Kalor mengalir secara spontan dari benda
bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam
arah kebalikannya.”
Hukum
II Termodinamika mengatakan bahwa perubahan entropi (ketidakteraturan sebuah
sistem) selalu lebih besar atau sama dengan nol. Hal ini mengimplikasikan bahwa
ketidakaturan sebuah sistem cenderung meningkat jika sistem itu menerima energi
dari luar. Perubahan entropi nol hanyalah terjadi pada sistem yang sudah
setimbang (termal akan dinamis). Sistem yang tidak setimbang memeliki
kecenderungan berkembang kearah teratur (setimbang).
Jadi,
alam dan hukum alam telah mengajarkan kepada kita bahwa ketidakaturan
(peningkatan entropi) akan berlangsung di alam semesta ini (termasuk dalam
kehidupan kita sebagai pribadi, masyarakat, dan bangsa) samapai suatu saat
menjadi homogen (setimbang) dan pada kondisi seperti ini pula perubahan entropi
tidak terjadi lagi. Ada yang menafsirkan bahwa perubahan entropi yang sama
dengan nol merupakan akhir dari kehidupan dan perjalanan alam semesta ini.
Hukum III Termodinamika
Hukum
III Termodinamika terkait dengan termperatur nol absolut. Hukum III
Termodinamika ini menyatakan bahwa.
“Suatu sistem yang mencapai temperatur nol
absolut, semua prosesnya akan berhenti dan entropi sistem akan mendekati nilai
maksimu.””Entropi benda berstruktur kristal sempurna pada temperatur nol
absolut bernilai nol."
Sumber :
- Damanik, Asan. 2009. Pendidikan Sebagai Pembentukan Watak Bangsa Sebuah Refleksi Konsteptual-Kritis dari Sudut Pandang Fisika. Yogyakarta : Penerbit Universitas Sanata Dharma.
- Damanik, Asan. 2009. Pendidikan Sebagai Pembentukan Watak Bangsa Sebuah Refleksi Konsteptual-Kritis dari Sudut Pandang Fisika. Yogyakarta : Penerbit Universitas Sanata Dharma.
- Ikatan
Tutor Indonesia. 2015. A-Z Menguasai
Fisika dalam 10 Menit. Yogyakarta : Penerbit Indoliterasi.








No comments
silahkan berkomentar secara bijak dan sesuai dengan topik pembahasan